NSCLC
Nicht-kleinzelliges Lungenkarzinom
NSCLC: Epidemiologie, Symptome, Diagnostik und Therapie
Das Lungen- oder auch Bronchialkarzinom gehört zu den häufigsten malignen Tumoren in den deutschsprachigen Ländern.1,2 In den letzten Jahren hat der Einsatz von Immun- und zielgerichteten Therapien die Überlebensraten von Betroffenen deutlich verbessert: Molekulardiagnostische Untersuchungen sind essenziell, um für solche Therapien geeignete Patient:innen zuverlässig zu identifizieren.1,2

Dann loggen Sie sich hier ein, um mehr über unser Präparat im NSCLC zu erfahren. Nach Login finden Sie interessante Studiendaten, hilfreiche Tipps zur Anwendung und praktische Materialien.
1. Fakten und Grundlagen
Lungenkarzinome gehen aus Epithelzellen der Lunge hervor. Dabei ist Lungenkarzinom jedoch nicht gleich Lungenkarzinom: In den vergangenen Jahren sind verschiedene Entitäten identifiziert worden, die sich in ihren histologischen und molekularen Eigenschaften unterscheiden.1,2
Lungenkarzinom-Subtypen: NSCLC oder SCLC, Adenokarzinom oder Plattenepithelkarzinom
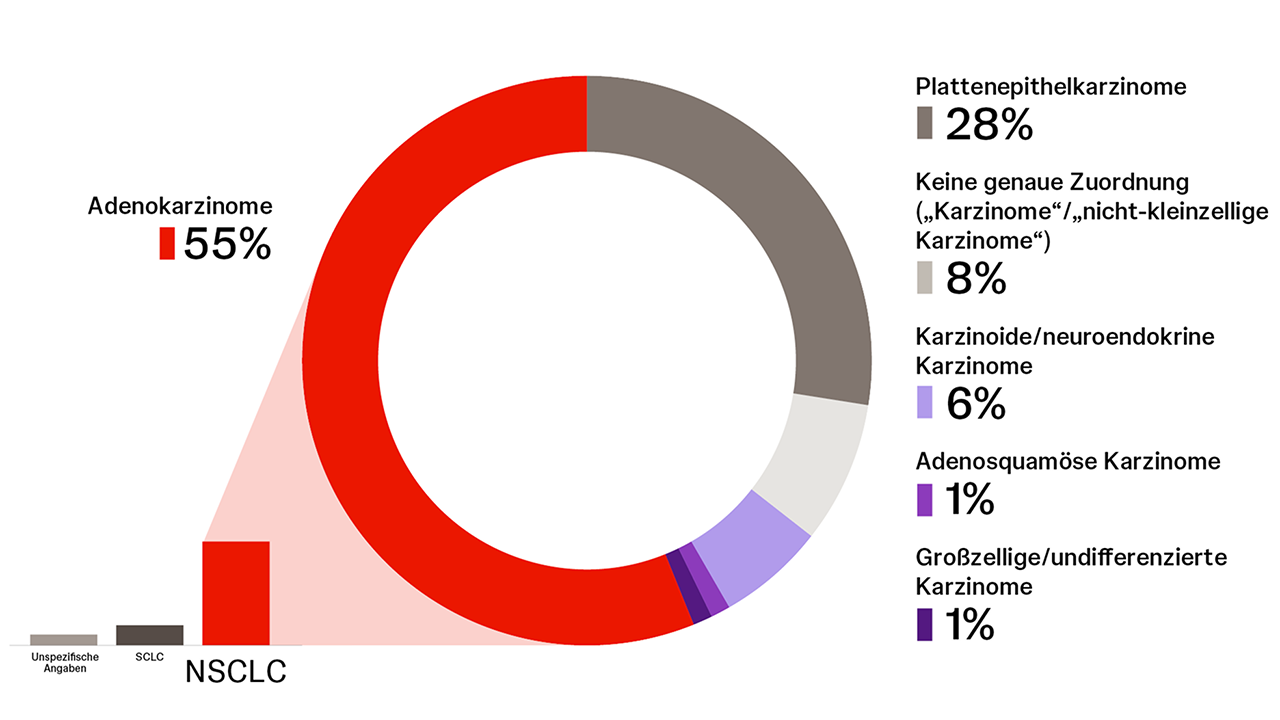
In Therapie-orientierten Leitlinien werden klein- und nicht-kleinzellige Karzinome (small-cell lung cancer, SCLC, bzw. non-small cell lung cancer, NSCLC) unterschieden. Bei nicht-kleinzelligen Karzinomen wird weiter nach histologischen, genetischen und immunhistochemischen Parametern differenziert.1,2 Die aktuelle histologische Klassifikation des NSCLC schließt neben den Adenokarzinomen – der häufigsten Unterform –, Plattenepithelkarzinomen und dem großzelligen Karzinom auch neuroendokrine Tumore ein. Innerhalb dieser Gruppen werden teils weitere Varianten unterschieden.1,2
Häufigkeiten klein- und nicht-kleinzelliger Karzinome in Deutschland (2020–2022)
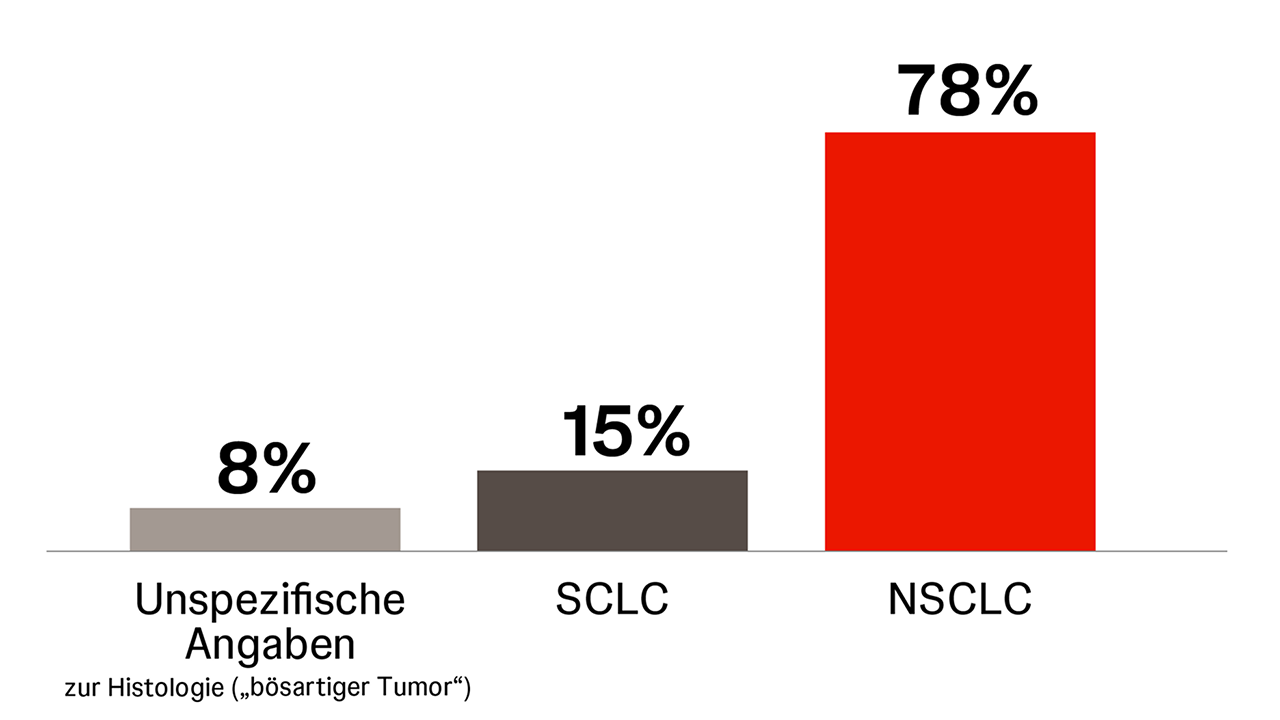
Prozentwerte ergeben durch Rundung u.U. nicht 100%. Es existieren Unterschiede hinsichtlich der histologischen Subgruppen zwischen den Geschlechtern.
Häufigkeiten histologischer NSCLC-Subgruppen in Deutschland (2020–2022)
2. Ursachen und Häufigkeit des NSCLC
Risikofaktoren für Lungenkarzinome sind vielfältig
Das Risiko, an einem Lungenkarzinom zu erkranken, kann durch verschiedene exogene (äußere) und endogene (körpereigene) Faktoren begünstigt werden. Rauchen, insbesondere in aktiver Form aber auch als Passivrauchen bleibt der bedeutendste exogene Risikofaktor und so zählen Raucherprävention und -entwöhnung zu den wichtigsten Strategien, um das Risiko für die Entstehung eines Lungenkarzinoms zu verringern.1-3
Allerdings können gerade Adenokarzinome auch unabhängig von Tabakkonsum oder Schadstoffexposition entstehen: Das Wachstum des Tumors wird bei diesen NSCLC-Unterformen häufig durch sogenannte Treibermutationen stimuliert.4 Weitere Risikofaktoren für die Entstehung eines Lungenkarzinoms können eine berufliche Exposition gegenüber Schwermetallen, bestimmten Gasen, Asbest, Umweltverschmutzung, medizinische Strahlenexposition und spezifische Krankheiten wie eine chronisch obstruktive Lungenerkrankung (COPD) sein.1,2
Epidemiologie: Lungenkarzinom ist weltweit häufigste Krebserkrankung
Epidemiologie des Lungenkarzinoms in Deutschland
Weltweit war das Lungenkarzinom im Jahr 2022 mit knapp 2,5 Mio. neu diagnostizierten Fällen die häufigste Krebsart und lag auf Rang 1 der krebsbedingten Sterbefälle.5 In den deutschsprachigen Ländern gehört das Lungenkarzinom zu den häufigsten malignen Tumoren.1,2 Bei Frauen stellte es im Jahr 2020 die zweithäufigste, bei Männern hingegen die häufigste krebsbedingte Todesursache dar.3 Obwohl sich Diagnose und Therapie in den vergangenen Jahren rasant weiterentwickelt haben, gehört das Lungenkarzinom weiterhin zu den prognostisch ungünstigen Tumoren: Noch immer besteht in bestimmten biologischen Entitäten ein hoher medizinischer Bedarf.1-3

Lungenkarzinom-Früherkennung in Deutschland
Gegenwärtig (Stand Juli 2025) ist in Deutschland kein strukturiertes Lungenkarzinom-Früherkennungsprogramm implementiert. Jedoch wurden laut aktueller onkopedia-Leitlinie die Voraussetzungen für ein nationales Früherkennungsprogramm in den letzten Jahren geschaffen. Mit Inkrafttreten der entsprechenden Verordnung am 1. Juli 2024 sei die Lungenkrebsfrüherkennung für Risikopersonen mittels Niedrigdosis-Computertomographie (Low-Dose-CT oder LDCT) in Deutschland prinzipiell erlaubt. Die genauen Ausführungsbestimmungen und insbesondere die Bedingungen der Kostenerstattung würden allerdings derzeit noch vom G-BA festgelegt.2 Die aktuelle S3-Leitlinie warnt in diesem Zusammenhang vor den Gefahren eines unstrukturierten, nicht qualitätsgesicherten Screenings.1
3. Symptome des NSCLC
Ein Lungenkarzinom im Frühstadium ist häufig asymptomatisch. Treten doch Symptome auf, sind diese oft unspezifisch, weshalb bei mehr als 50% der Betroffenen die Erkrankung erst in fortgeschrittenen Stadien diagnostiziert wird.1,2 Ein persistierender oder sich verschlimmernder Husten ist das häufigste Symptom bei Vorstellung. Zudem können gerade in späten Stadien Symptome vorliegen, die für das Vorhandensein von Fernmetastasen sprechen.1,2
Mögliche Symptome beim Lungenkarzinom1,2
- Husten
- Atemnot (Dyspnoe)
- Schmerzen im Brustkorb (Thoraxschmerzen)
- Bluthusten (Hämoptyse)
- Pfeifende Atmung (Stridor)
- Schluckstörungen (Dysphagie)
- Heiserkeit
- Armschwäche
- Schmerzen, z.B. Knochen- oder Kopfschmerzen
- Schwindel, neurologische Ausfälle, Verwirrtheit, Krampfanfälle
- Lymphknoten-Schwellung (oberhalb des Schlüsselbeins)
- Gelbsucht (Ikterus)
- Gewichtsverlust
- Schwäche
- Fieber
- Nachtschweiß
4. Diagnose des NSCLC
Den Anfang der Erstdiagnose bildet meist ein ausführliches Anamnese-Gespräch zu Beschwerden, Lebensgewohnheiten, eventuellen früheren Erkrankungen oder möglichen familiären Vorbelastungen. Dieses Anamnese-Gespräch wird in der Regel gefolgt von einer erweiterten Diagnostik mit dem Ziel der Bestätigung der klinischen und/oder bildgebenden Verdachtsdiagnose.1,2
Welche Diagnoseverfahren kommen beim Lungenkarzinom zum Einsatz?
Aktuelle Leitlinien empfehlen beim Lungenkarzinom die folgende Basisdiagnostik:1,2
Laboruntersuchung
- Laborchemische Untersuchung:
u.a. Blutbild, Elektrolyte, Nierenparameter, Leberparameter, Lactatdehydrogenase (LDH), Gerinnung
Bildgebung
1. Bestätigung der Verdachtsdiagnose
- Erste Wahl: CT mit Kontrastmittel von Brusthöhle (Thorax) und Oberbauch oder Positronenemissionstomographie (PET) mit diagnostischem CT (PET-CT)
- Alternativ zum CT: Magnetresonanztomographie (MRT) mit Kontrastmittel von Brusthöhle (Thorax) und Oberbauch
- Bildgebungsgeführte Bronchoskopie: endoskopische Lungenspiegelung
2. Ausbreitungsdiagnostik
- Sonographie vom Oberbauch
- Ganzkörper-PET-CT oder -MRT: bei kurativem Therapiekonzept
- endobronchialer oder endoösophagealer Ultraschall (EBUS/EUS): zur Abklärung von mediastinalen Lymphknotenmetastasen
- MRT vom Schädel: zur Abklärung von Hirnmetastasen (bei Kontraindikation gegen MRT ersatzweise CT des Schädels)
- Knochenszintigraphie: zur Abklärung von Knochenmetastasen
- CT vom Abdomen: einschließlich Nebennieren, unterem Leberrand und Becken; zur Abklärung von Viszeralmetastasen
Gewebeuntersuchengen
- Gewebe-Entnahme: kann im Rahmen der Bronchoskopie oder des endobronchialen Ultraschalls erfolgen, alternativ durch transthorakale Punktion (Entnahme von außen durch die Brust)
- Histologische Untersuchungen: Mikroskopische Untersuchung des Tumorgewebes, um die Unterform des Lungenkarzinoms zu ermitteln
- Molekularbiologische Untersuchungen: Analyse des Tumorgewebes auf mögliche prädiktive Biomarker, z.B. Treibermutationen oder PD-L1-Expression
Stadieneinteilung beim Lungenkarzinom
Da das Krankheitsstadium neben anderen Faktoren einen wesentlichen Einfluss auf die Therapiewahl hat, muss beim Lungenkarzinom regelhaft eine Stadieneinteilung erfolgen.1 Dieses Staging bezieht außer den TNM- auch die UICC-9-Kriterien mit ein. Gemäß dieser Klassifikation ergeben sich durch bestimmte Kombinationen der Parameter „Größe des Primärtumors (T)", „Beteiligung regionärer Lymphknoten (N)" sowie „Vorliegen von Fernmetastasen (M)" einerseits die Stadien I–IV und andererseits die Unterstadien A–C. Teils werden die Unterstadien noch weiter aufgeteilt, bspw. erfolgt beim Stadium IIIA zusätzlich eine Einteilung nach Robinson.1,2
5. Molekulardiagnostik: nicht nur beim metastasierten Adenokarzinom immer wichtiger
Bestimmte Treibermutationen und Proteine können beim NSCLC das Tumorwachstum fördern.1,2 Da für diese sogenannten Biomarker zunehmend zielgerichtete oder immunonkologische Behandlungsoptionen existieren, ist die molekulare Charakterisierung der Tumorzellen für die Therapiewahl essenziell.1,2
Molekulardiagnostische Methoden
Je nach Art des zu untersuchenden Biomarkers sind unterschiedliche Nachweis-Methoden möglich, oft spielen neben der generellen Durchführbarkeit auch Faktoren wie Kosten, Umlaufzeit (Turnaround-Time, TAT) und Sensitivität eine Rolle.6
Der Nachweis von genetischen Veränderungen kann mittels Next-Generation-Sequencing (NGS) oder Polymerase-Kettenreaktion (PCR) erfolgen. Je nach Methode lässt sich die NGS-Testung umfassend und flexibel einsetzen: Bei Einsatz des Hybrid-Capture-NGS beispielsweise können tausende Gene ohne vorherige Kenntnis zur DNA-Sequenz gleichzeitig analysiert werden.7 PCR-basierte Verfahren sind zwar in der Regel einfacher und preisgünstiger, decken aber nur spezifische vordefinierte Zielsequenzen ab. So kann es sein, dass gerade seltene Treibermutationen unentdeckt bleiben.6-8
Nachweis seltener Mutationen: PCR oder NGS?
Für den Nachweis seltener Mutationen, z. B. Insertionsmutationen in Exon 20 oder Punktmutationen im Exon 18 des EGFR-Gens, kommen prinzipiell sowohl PCR-basierte Verfahren als auch das NGS infrage. Häufig können kommerzielle PCR-Tests jedoch nur wenige ausgewählte Mutationen detektieren.8 Da sie die sensitive, umfassende und zuverlässige Identifizierung aller potenziell therapierelevanten Mutationen ermöglichen, empfehlen nationale und internationale Expert:innen mittlerweile bevorzugt die Anwendung NGS-basierter Strategien im Rahmen der molekularen Tumordiagnostik.1,8-11
Erstattungssituation: Wie verhält es sich mit der Erstattung der NGS-Testung im Praxisalltag?

Medizinische Leistungen, die im vertragsärztlichen ambulanten Bereich zulasten der Gesetzlichen Krankenversicherung (GKV) erbracht werden, werden über den Einheitlichen Bewertungsmaßstab (EBM) abgerechnet. Er beinhaltet alle abrechnungsfähigen Leistungen, so auch die Gebührenordnungspositionen (GOPs) zur molekularen Testung.12
Stationäre Leistungen werden vorrangig über DRG-Fallpauschalen vergütet. Weitere Möglichkeiten der Abrechnung stationärer Leistungen sind unter anderem die ASV-Versorgung und Verträge der besonderen Versorgung nach §140a SGB V.13 Beispiele für besondere Versorgungsverträge im Lungenkarzinom sind das nationale Netzwerk für genomische Medizin (nNGM), die Zentren für Personalisierte Medizin (ZPM) oder das Lungennetzwerk NOWEL.14-16
Für den Nachweis von genetischen Rearrangements (beispielsweise Translokationen), Amplifikationen und Deletionen wird meist die Fluoreszenz-in-situ-Hybridisierung (FISH) verwendet, bei der markierte DNA-Sonden zum Einsatz kommen. Je nach Target kann die FISH auch durch bestimmte NGS-Verfahren oder durch die Immunhistochemie (IHC) ersetzt werden.6
Ein bekannteres Einsatzgebiet der IHC ist die Bestimmung des PD-L1-Status, bei der das Vorhandensein oder Fehlen des Checkpoint-Moleküls Programmed Death-Ligand (PD-L1) auf den Tumorzellen untersucht wird.6
Welche genetischen Veränderungen können beim NSCLC auftreten?
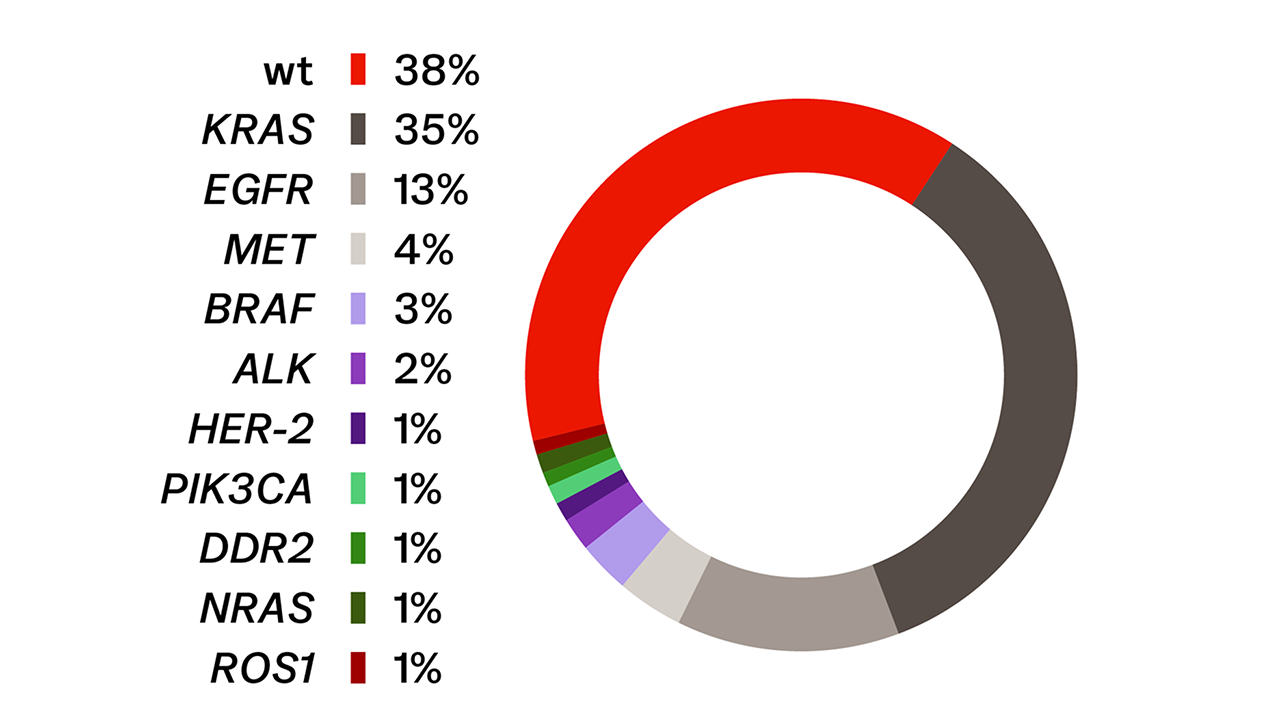
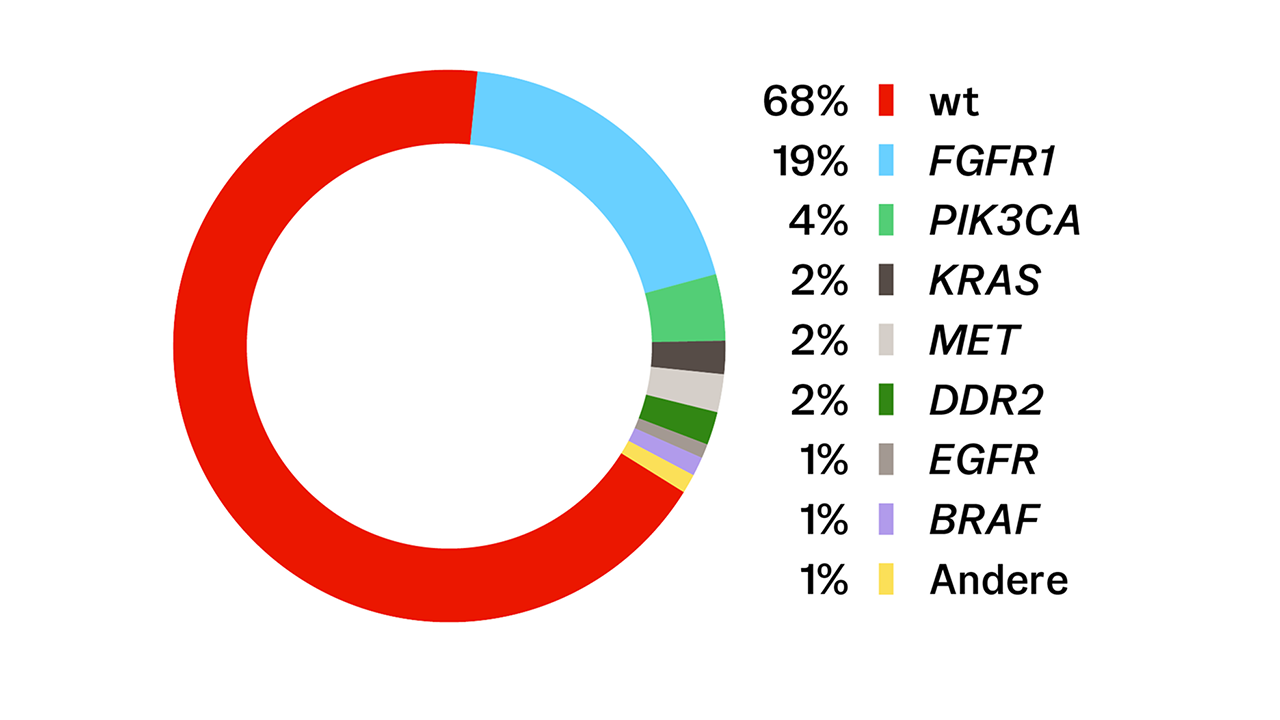
Treibermutationen können beim NSCLC dazu führen, dass zelluläre Signalwege dauerhaft aktiviert sind. Sie fördern so das unkontrollierte Wachstum von Krebszellen.4,17 Mittlerweile sind zahlreiche solcher mit dem Tumorwachstum in Zusammenhang stehende Genveränderungen identifiziert worden. Ihre Häufigkeiten können je nach NSCLC-Unterform variieren: So weisen Adenokarzinome vermehrt Veränderungen in den Genen EGFR, KRAS und ALK auf, während bei Karzinomen mit plattenepithelialer Histologie vor allem Veränderungen in den Genen PIK3CA und FGFR1 vorkommen.18
NSCLC: Genetische Veränderungen und ihre Häufigkeiten beim Adenokarzinom
NSCLC: Genetische Veränderungen und ihre Häufigkeiten beim Plattenepithelkarzinom
Was testen und wann testen?
Aufgrund der zunehmenden Verfügbarkeit von zielgerichteten und Immuntherapien – auch für frühe Stadien des NSCLC – enthalten die deutschen Leitlinien mittlerweile verschiedene Empfehlungen zur Molekulardiagnostik.1,2
Molekularbiologische und immunhistochemische Diagnostik (gem. deutscher Leitlinien, Stand April 2025)1,2
- ALK-Translokationen
- EGFR-Mutationen (del19 und L858R)
- PD-L1-Expression
- ALK-Translokationen
- BRAF-V600-Mutation
- aktivierende EGFR-Mutationen (Exons 18–21 plus T790M)
- HER2-Mutationen
- KRAS-G12C-Mutation
- MET-Exon-14-Skipping-Mutation
- NTRK-Translokationen
- RET-Translokationen
- ROS1-Translokationen
- PD-L1-Expression
Obwohl beim Adenokarzinom häufiger therapierelevante Treibermutationen auftreten als beispielsweise beim Plattenepithelkarzinom, sollten alle Patient:innen in den genannten Stadien unabhängig vom Subtyp getestet werden.1,2,17 Auch vor Beginn einer Zweitlinientherapie kann eine (erneute) Molekulardiagnostik angezeigt sein, um mögliche Resistenzmutationen zu identifizieren.1,2
Soll ein invasiver Eingriff vermieden werden, kann die Liquid Biopsy, bei der Tumormarker im Blut analysiert werden, eine Option darstellen. Da die Rate falsch-negativer Ergebnisse im Vergleich zur Molekulardiagnostik anhand von Gewebematerial erhöht ist, wird bei negativer Liquid Biopsy eine zusätzliche Gewebeentnahme empfohlen.1,2,19 Für die initiale Diagnose, histologische Befundung und Einleitung der Therapie ist die Gewebebiopsie weiterhin unumgänglich.
6. Verlauf und Prognose des NSCLC
Verlauf und Prognose des Lungenkarzinoms sind patientenindividuell und abhängig von eventuell vorliegenden Treibermutationen oder immunologischen Markern, von der Histologie, vom Geschlecht und Allgemeinzustand des Patienten oder der Patientin, von der lungenfunktionellen Reserve sowie von Komorbiditäten.2 Aufgrund der immer zahlreicheren und immer besser werdenden Therapiemöglichkeiten hat sich die Prognose für Patient:innen in den letzten Jahren insgesamt deutlich verbessert. Je früher ein Lungenkarzinom entdeckt wird, desto eher kann die Therapie starten.1,2

7. Therapie des NSCLC
Die Behandlung des NSCLC erfolgt zunehmend personalisiert: Lokale, systemische, sowie medikamentöse und nicht-medikamentöse Therapiemöglichkeiten lassen sich unterscheiden. Teils kommen verschiedene Behandlungsansätze als Kombinationstherapie zum Einsatz.1,2
Operation
In frühen, lokal begrenzten Stadien kann der Lungentumor meist noch operativ entfernt werden, eine Heilung ist theoretisch möglich. Je nach Lage und Größe umfasst die operative Entfernung ein kleines Lungensegment (Keilresektion), einen Lungenlappen (Lobektomie) oder einen kompletten Lungenflügel (Pneumektomie).1,2,11 Unter Umständen kommt vor der Operation eine systemische, tumorverkleinernde – auch neoadjuvante – Therapie zum Einsatz. Wird eine systemische Therapie im Anschluss an die Operation gegeben, spricht man von einer adjuvanten Behandlung.
Strahlentherapie
Bei der Strahlen- oder Radiotherapie werden Krebszellen mithilfe von Strahlen zerstört. Das genetische Material der Krebszellen wird geschädigt, sodass diese sich nicht mehr vermehren können und absterben.20 Um eine präzise Bestrahlung zu erreichen und so Schäden am umliegenden Gewebe gering zu halten, kommen häufig bildgebende oder computerassistierte Zielführungssysteme zum Einsatz.1,2 Zudem kann die Strahlendosis auf mehrere Einzelsitzungen (Fraktionen) aufgeteilt werden.1,2
Chemotherapie
Bei der Chemotherapie werden Medikamente – sogenannte Zytostatika – eingesetzt, die bestimmte Zellteilungsprozesse hemmen.21
Dadurch sterben die sich häufig teilen- den Krebszellen vermehrt ab, ihre unkontrollierte Vermehrung wird unterdrückt. Neben Krebszellen können auch teilungsaktive, gesunde Körperzellen wie Schleimhaut-, Haarwurzel- oder blutbildende Zellen betroffen sein. Verschiedene Klassen von Zytostatika existieren, die sich in Wirkweise wie Nebenwirkungsprofil unterscheiden.21
Zielgerichtete und Immuntherapie
Zielgerichtete Therapien und Immuntherapien richten sich spezifisch gegen bestimmte molekulare Charakteristika der Krebszellen, die mit dem Tumorwachstum assoziiert sind. Im Vergleich zur unspezifischeren Chemotherapie sind diese Wirkstoffe mit Vorteilen hinsichtlich der Wirksamkeit und Verträglichkeit verbunden.1,2,22 Lange wurden zielgerichtete und Immuntherapien nur im Stadium IV verabreicht. Inzwischen können sie je nach Art des Targets auch schon in den operablen Stadien als adjuvante Behandlung zum Einsatz kommen.1,2
Zielgerichtete Therapie gegen Treibermutationen
Das Target zielgerichteter Therapien sind genetische Veränderungen: Diese können Punktmutationen, Deletionen, Fusionen, Translokationen und Amplifikationen umfassen. Zu den häufigsten therapierbaren Alterationen gehören Mutationen der Signalproteine KRAS (z. B. KRAS G12C) und EGFR (z. B. EGFR L858R).18 Zielgerichtete Therapien, darunter Tyrosinkinase-Inhibitoren, binden passgenau an ihre jeweilige Zielstruktur und blockieren so nachgeschaltete zelluläre Signalwege, die im Zuge der malignen Transformation außer Kontrolle geraten sind. Wachstums- und Vermehrungsprozesse des Tumors können somit zielgenau unterbunden werden.18,23
Immuntherapie
Teils können sich Zellen des Tumors gegenüber dem körpereigenen Immunsystem tarnen. Die Immuntherapie kann diese Tarnung aufheben, sodass die Krebszellen wieder als bösartig erkannt und daraufhin von Immunzellen beseitigt werden.24 Für das NSCLC sind verschiedene sogenannte Checkpoint-Inhibitoren zugelassen, die sich gegen die Zielstrukturen PD-1, PD-L1 oder CTLA-4 richten können.1,2,24

Therapie des NSCLC in den Stadien I–III
In den Stadien IA-IIB gehören die Operation, die Strahlentherapie und die Chemotherapie zu den empfohlenen Therapiemaßnahmen. Mittlerweile sind auch bestimmte Biomarker-basierte Therapien zugelassen. Es besteht übergreifend ein kurativer Therapieanspruch, das heißt eine Heilung ist möglich und wird angestrebt.1,2 Im Stadium III wird eine sehr heterogene Gruppe von Patient:innen zusammengefasst. Nicht in allen Fällen ist es lokal kurativ zu behandeln und häufig werden individuelle Therapieempfehlungen ausgesprochen – grundsätzlich besteht jedoch auch hier ein kurativer Therapieanspruch.1,2
Mögliche Therapiestruktur des NSCLC in den primär resektablen Stadien (Stadien IA–IIIB; gem. deutscher Leitlinien, Stand April 2025)1,2
- Primäre Therapieoption ist die Operation
- ggf. neoadjuvante Chemotherapie oder kombinierte Chemoimmuntherapie
- ggf. adjuvante Chemotherapie, je nach Vorliegen molekularer Marker auch adjuvante Mono-Immuntherapie oder zielgerichtete Therapie
Mögliche Therapiestruktur des NSCLC in den primär nicht-resektablen Stadien (Stadien IIIA3,4, IIIB [außer T3N2] & IIIC, gem. deutscher Leitlinien, Stand April 2025)1,2
- Aktuelle Standardtherapie ist die Platin-haltige Chemotherapie mit begleitender Strahlentherapie (= definitive Radiochemotherapie, u.U. auch nacheinander bei schlechtem Allgemeinzustand und/oder Komorbidität)
- bei PD-L1 > 1% und Progressionsfreiheit: anschließende Konsolidierung mit Checkpoint-Inhibitor
- bei EGFR-del19/L858R und Progressionsfreiheit: anschließende Konsolidierung mit EGFR-TKI
- bei Nichteignung für definitive Radiochemotherapie und
- PD-L1 ≥ 50%: ggf. Mono-Immuntherapie
- PD-L1 ≥ 1%: ggf. kombinierte Chemoimmuntherapie
- In den Stadien IIIA4 und IIIB ist in Einzelfällen ein multimodales Konzept mit Operation möglich
- PD-L1 < 1%: primäre Chemotherapie, gefolgt von Operation, ggf. gefolgt von Bestrahlung Mediastinum
- PD-L1 < 1%: primäre Chemotherapie, gefolgt von Radiochemotherapie, gefolgt von Operation
- PD-L1 ≥ 1%: primäre Immunchemotherapie, gefolgt von Radiochemotherapie, ggf. gefolgt von Operation
Therapie des NSCLC im Stadium IV
Das NSCLC ist bei Metastasierung in der Regel inoperabel. Eine Ausnahme bilden Betroffene im oligometastasierten Stadium, z.B. mit solitären Nebennieren-, ZNS-, Lungen- oder Knochenmetastasen, bei denen ein potenziell kurativer Therapieansatz infrage kommt.1,2
Bei der Mehrzahl der Patient:innen im Stadium IV ist der Therapieanspruch jedoch palliativ.1,2 Therapieziele sind vordergründig die Verlängerung des Überlebens, die Symptomlinderung und der Erhalt der Lebensqualität. Seit einigen Jahren halten Biomarker-basierte Therapien Einzug im Praxisalltag.1,2
Mögliche Therapiestruktur des NSCLC im Stadium IV (gem. deutscher Leitlinien, Stand April 2025)1,2
Stadium | Mögliche Therapie |
|---|---|
Stadium Stadium IV oligometastatisch | Mögliche Therapie In Abhängigkeit von der Tumorlast, Vorliegen von Hirnmetastasen oder lokalen tumorbedingten Komplikationen:
|
Stadium Stadium IV | Mögliche Therapie
|
Immuntherapie beim metastasierten NSCLC ohne therapierelevante Treibermutation
Beim NSCLC im Stadium IV ohne therapierelevante Treibermutation ist der Einsatz von Checkpoint-Inhibitoren eine Option.1,2 Bei hoher PD-L1-Expression (Tumor Proportion Score, TPS ≥50%) können bestimmte PD-1- oder PD-L1-Inhibitoren als Monotherapie verwendet werden. Unabhängig vom PD-L1-Status ist zudem eine Kombination aus Immuntherapie und Chemotherapie möglich.1,2
Zielgerichtete Therapie beim NSCLC mit therapierelevanter Treibermutation
Beim NSCLC mit therapierelevanter Treibermutation – bspw. Veränderungen in den Genen KRAS, EGFR oder ALK – ist die Behandlung der Wahl in aller Regel die zielgerichtete Therapie.1,2,11
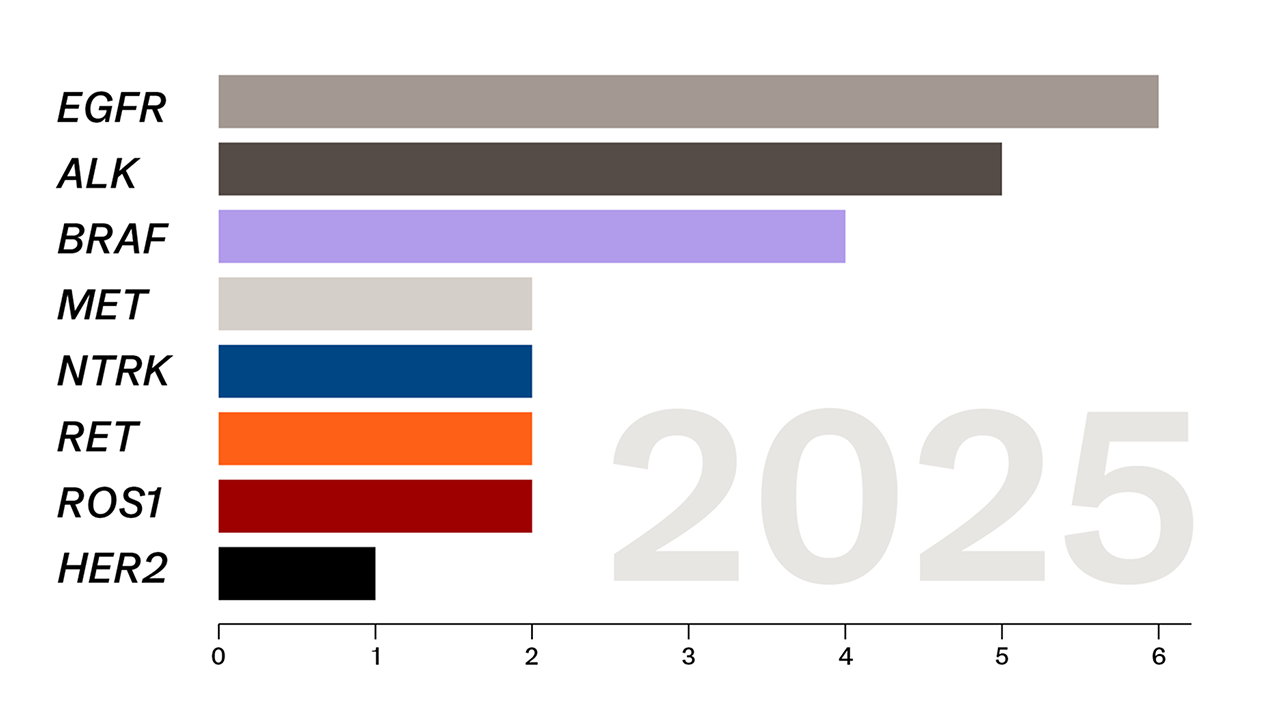
Die Wirkstoffe richten sich patientenindividuell nach der Art der vorliegenden Treibermutation. Über die Jahre wurden verschiedene zielgerichtete Substanzen in Europa zugelassen (siehe Abb.), von bestimmten Wirkstoffklassen existieren bereits mehrere Generationen.1,2,25 Weitere Substanzen werden derzeit in klinischen Studien untersucht.26
Anzahl zielgerichteter Wirkstoffe beim NSCLC (alle Stadien; zugelassen in der EU mit Stand Juli 2025)
Mangel an zielgerichteten Therapien für bestimmte Treibermutationen und Resistenzen
Trotz dieser Fortschritte bleibt der medizinische Bedarf beim NSCLC hoch. Einerseits fehlen für bestimmte Treibermutationen weiterhin wirksame zielgerichtete Therapien, andererseits kann die Entwicklung von Resistenzmechanismen die langfristige Wirksamkeit von zielgerichteten Therapien einschränken.1,2
Bei einer Resistenzentwicklung kann der Tumor unter einer zunächst erfolgreichen Therapie erneut wachsen und/oder sich im Körper ausbreiten.27 Bei Resistenzentwicklung und Progress unter der Erstlinientherapie wird eine Zweitlinienbehandlung nötig. Idealerweise existiert eine wirksame zielgerichtete Therapieoption für diese Therapielinie, allerdings ist das nicht immer gegeben.1,2 Immer häufiger werden sogenannte „hit hard and hit early"-Therapieansätze in Studien untersucht, die einer Resistenzentwicklung von Beginn an entgegenwirken sollen.26
8. Fazit für die Praxis
Beim metastasierten NSCLC hat es auf dem Gebiet der Biomarker-basierten Therapien in den letzten Jahren große Fortschritte gegeben. Verglichen mit der Chemotherapie hat dies zu einer deutlichen Verbesserung der Prognose von Betroffenen geführt.1,2 Allerdings besteht weiterhin ein hoher medizinischer Bedarf in dieser Entität und so laufen derzeit klinische Studien, welche Wirkstoffe der nächsten Generation, zielgerichtete Therapien gegen aktuell nicht therapierbare Treibermutationen, Wirkstoffe mit neuen Wirkprinzipien oder Kombinationen verschiedener Wirkstoffe untersuchen.26 Eine breite Molekulardiagnostik bildet die Grundlage, um geeignete Patient:innen zuverlässig zu identifizieren.1,2
Das könnte Sie auch interessieren


Referenzen
- S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. Version 4, April 2025. https://www.leitlinienprogramm-onkologie.de/leitlinien/lungenkarzinom. Letzter Zugriff: 21.07.2025
- onkopedia-Leitlinie Lungenkarzinom, nicht-kleinzellig (NSCLC). Stand: April 2025. https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html. Letzter Zugriff: 21.07.2025
- Zentrum für Registerdaten und Gesellschaft der Epidemiologischen Krebsregister in Deutschland e.V. Krebs in Deutschland für 2019/2020. 14. Ausgabe. https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/krebs_in_deutschland_2023.pdf?__blob=publicationFile. Letzter Zugriff: 21.07.2025
- European Society for Medical Oncology (ESMO). Non-Small-Cell Lung Cancer: A Guide for Patients. https://www.esmo.org/for-patients/patient-guides/non-small-cell-lung-cancer. Letzter Zugriff: 21.07.2025
- Bray F, et al. CA Cancer J Clin. 2024
- Neal JW. Personalized, genotype-directed therapy for advanced non-small cell lung cancer. https://www.uptodate.com/contents/personalized-genotype-directed-therapy-for-advanced-non-small-cell-lung-cancer. Letzter Zugriff: 21.07.2025
- Illumina Inc. Differences Between NGS and qPCR https://emea.illumina.com/science/technology/next-generation-sequencing/ngs-vs-qpcr.html. Letzter Zugriff: 21.07.2025
- Viteri S, et al. Mol Oncol. 2023; 17(2): 230–237.
- Mosele F, et al. Ann Oncol. 2020;31(11):1491-505
- Passaro A, et al. Ann Oncol. 2022;33(5):466-87
- NCCN Guidelines®: Non-Small Cell Lung Cancer. Version 7.2025 — July 10, 2025. https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf. Letzter Zugriff: 21.07.2025
- Kassenärztliche Bundesvereinigung (KBV). Online-Version des Einheitlichen Bewertungsmaßstabs (EBM). https://ebm.kbv.de/. Letzter Zugriff: 21.07.2025
- ASV-Servicestelle. ASV-Verzeichnis, Leistungsbereich: Tumore der Lungen und des Thorax. https://www.asv-servicestelle.de/home/asv-verzeichnis. Letzter Zugriff: 21.07.2025
- Lungennetzwerk NOWEL. https://www.nowel.org/. Letzter Zugriff: 21.07.2025
- Nationales Netzwerk Genomische Medizin (nNGM) Lungenkrebs. https://nngm.de/. Letzter Zugriff: 21.07.2025
- Zentren für Personalisierte Medizin (ZPM). https://zpm-verbund.de/. Letzter Zugriff: 21.07.2025
- Nationales Netzwerk Genomische Medizin (nNGM) Lungenkrebs. Treibermutationen. Stand: März 2024. https://nngm.de/patienten/treibermutationen/. Letzter Zugriff: 21.07.2025
- Testa U, Castelli G, and Pelosi E. Cancers (Basel). 2018;10(8)
- Olson DR. The 'Liquid' Biopsy. https://www.cap.org/member-resources/articles/the-liquid-biopsy. Letzter Zugriff: 21.07.2025
- Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ). Bestrahlung bei Krebs: Häufige Fragen zur Strahlentherapie und Nuklearmedizin. Stand: 2018. https://www.krebsinformationsdienst.de/behandlung/strahlentherapie-nuklearmedizin/ueberblick.php. Letzter Zugriff: 21.07.2025
- Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ). Chemotherapie-Medikamente: Wirkstoffe und Nebenwirkungen. Stand: 2019. https://www.krebsinformationsdienst.de/behandlung/chemotherapie/nebenwirkungen.php. Letzter Zugriff: 21.07.2025
- Ai X, et al. Oncotarget. 2018;9(101):37589-607
- Chan BA und Hughes BG. Transl Lung Cancer Res. 2015;4(1):36-54
- Universitätsklinikum Freiburg. Immuntherapie. https://www.uniklinik-freiburg.de/medizin1/behandlung/therapien/immuntherapie.html. Letzter Zugriff: 21.07.2025
- European Medicines Agency (EMA). Medicines. https://www.ema.europa.eu/en/medicines. Letzter Zugriff: 21.07.2025
- Li S, et al. Cancers (Basel). 2023;15(11)
Unser Angebot erfüllt die afgis-Transparenzkriterien.
Die afgis-Zertifizierung steht für hochwertige Gesundheitsinformationen im Internet. Die Prüfung durch insgesamt zehn umfangreiche Kriterien bestätigt, dass die J&J Medical Cloud den medizinischen Fachkreis über gesundheitsrelevante Themen in seriöser, aktueller und qualitätsgesicherter Weise informiert.
EM-148885
