PAH-Risikogruppen
Wissenswertes zu den Risikofaktoren für eine PAH
Welche Patient:innen haben ein erhöhtes Risiko für eine pulmonal arterielle Hypertonie?
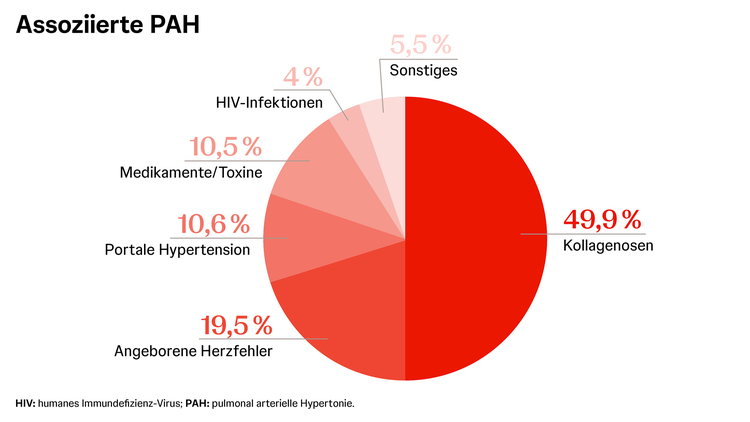
Wie genau eine pulmonal arterielle Hypertonie (kurz: PAH) – auch Lungenhochdruck genannt – entsteht, ist bisher nicht vollständig geklärt. Es sind allerdings einige mögliche Risikofaktoren bekannt, die die Entstehung der PAH begünstigen können. Dazu zählen neben einer HIV-Infektion, angeborenen Herzfehlern und Lebererkrankungen auch Autoimmunerkrankungen wie Kollagenosen (Bindegewebserkrankungen). Generell spricht man bei dieser Form der pulmonal arteriellen Hypertonie auch von „assoziierter pulmonal arterieller Hypertonie“, oder kurz APAH.1
Systemische Sklerose
Bei Kollagenosen wie systemischer Sklerose besteht ein erhöhtes PAH-Risiko
Eine Auswertung aus dem REVEAL-Register zeigte, dass Kollagenosen häufig mit der Entwicklung einer pulmonal arteriellen Hypertonie (PAH) assoziiert sind.2 Da der Verlauf bei pulmonal arterieller Hypertonie in Assoziation mit Kollagenosen oft schwerwiegend ist und eine hohe Mortalität aufweist, sollten Patient:innen mit Kollagenosen regelmäßig auf Anzeichen einer pulmonal arteriellen Hypertonie hin untersucht werden.1,3
Was sind Kollagenosen?
Kollagenosen sind eine Gruppe von Autoimmunerkrankungen, die das Bindegewebe und die Blutgefäße betreffen. Zu den Kollagenosen zählen:4
- systemische Sklerose, auch als Sklerodermie bekannt
- systemischer Lupus erythematodes
- Polymyositis und Dermatomyositis
- Sjögren-Syndrom
- Sharp-Syndrom
Von den Kollagenosen ist die systemische Sklerose am häufigsten mit einer pulmonal arteriellen Hypertonie assoziiert.1
Was ist systemische Sklerose?

Systemische Sklerose, kurz SSc, ist eine seltene rheumatische Autoimmunerkrankung aus der Gruppe der Kollagenosen. Sie ist gekennzeichnet durch eine Verhärtung der Haut und des Bindegewebes (Fibrose) sowie durch eine Schädigung der Blutgefäße (Vaskulopathie).5 Zu den typischen Symptomen gehören funktionelle Durchblutungsstörungen (Raynaud-Syndrom), geschwollene Finger („puffy fingers“) und Fingergeschwüre (digitale Ulzerationen). Die Symptomatik kann sich auf innere Organe wie Verdauungstrakt, Herz, Niere und Lungen ausweiten. Sind durch die Vaskulopathie auch die Lungenarterien betroffen, können Betroffene eine PAH entwickeln.6,7 Dies geschieht bei 8–12 % der SSc-Patient:innen.8 Man spricht in diesem Fall von einer pulmonal arteriellen Hypertonie in Assoziation mit systemischer Sklerose (PAH-SSc).
PAH ist eine der häufigsten Todesursachen bei systemischer Sklerose
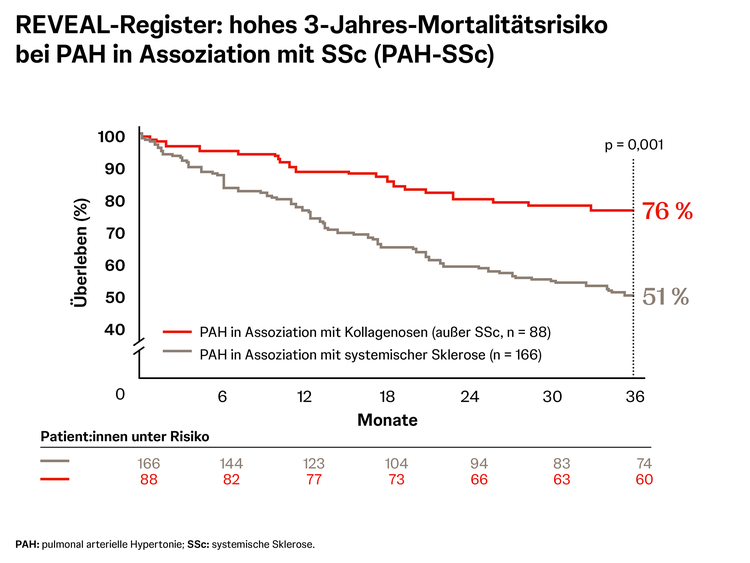
Pulmonal arterielle Hypertonie in Assoziation mit systemischer Sklerose verläuft oft schwerwiegender als idiopathische PAH (IPAH). Das spiegelt sich zum Beispiel auch in Registerdaten aus Kanada und den USA wider, die zeigen, dass mehr als 50 % der Todesfälle bei systemischer Sklerose durch PAH bedingt sind.9 Daten aus dem REVEAL-Register zeigten außerdem, dass die Prognose bei PAH in Assoziation mit systemischer Sklerose mit einer Überlebensrate von 51 % nach 3 Jahren besonders schlecht ist im Vergleich zu anderen Kollagenosen mit einer Überlebensrate von 76 %.10 Eine frühzeitige Diagnose und anschließende Behandlung mit gezielten PAH-Medikamenten sind daher für die Verbesserung der Prognose sehr wichtig.
Wie erkennt man PAH bei SSc-Patient:innen frühzeitig?
Die Früherkennung einer pulmonal arteriellen Hypertonie (PAH) bei Patient:innen mit systemischer Sklerose (SSc) ist oft schwierig, da die Erkrankung bei Beginn häufig einen klinisch unauffälligen Verlauf zeigt und sich nur in unspezifischen Symptomen wie Atemnot (auch: Dyspnoe) und Müdigkeit äußert.5
Durch Screening kann eine PAH bei Patient:innen mit systemischer Sklerose frühzeitig entdeckt werden
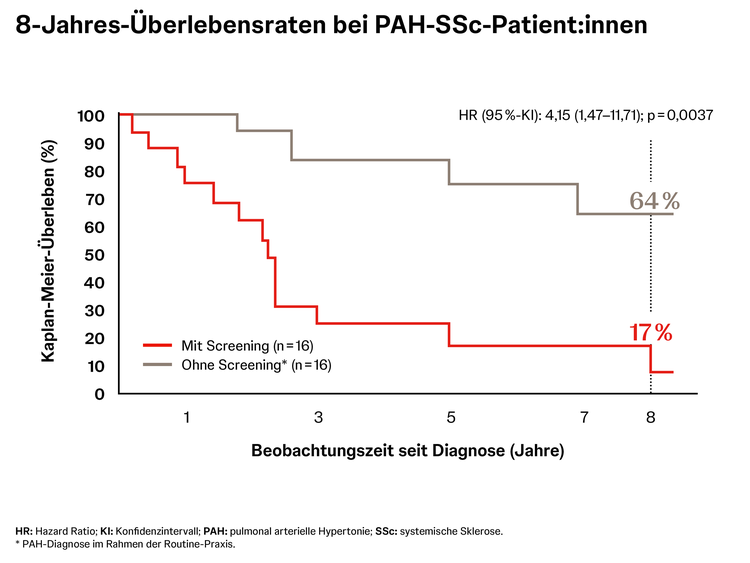
Studiendaten zeigen, dass durch ein gezieltes PAH-Screening bei Patient:innen mit systemischer Sklerose deutlich mehr PAH-Patient:innen in früheren Stadien (Funktionsklasse I oder II) identifiziert werden als durch Routineuntersuchungen ohne Screening. Dies zeigte sich auch bei der Mortalität. Bei gescreenten Patient:innen lag die 8-Jahres-Überlebensrate bei 64 %, während diese bei nicht gescreenten Patient:innen nur bei 17 % lag.11 Aus diesem Grund empfehlen die Leitlinien bei Patient:innen mit systemischer Sklerose ein jährliches PAH-Screening. Ergibt sich daraus der Verdacht auf eine PAH, sollte umgehend eine Überweisung an ein PH-Zentrum erfolgen, um die Diagnose anhand einer Rechtsherzkatheteruntersuchung zu bestätigen und eine gezielte PAH-Therapie starten zu können.1

Wie erfolgt das PAH-Screening bei systemischer Sklerose?
Die Leitlinien empfehlen bei Patient:innen mit systemischer Sklerose ein jährliches Screening auf pulmonal arterielle Hypertonie anhand von Echokardiografie und Biomarkern.1
Inzwischen gibt es dafür ein relativ einfaches PAH-Screeningtool, das für Patient:innen mit systemischer Sklerose entwickelt und validiert wurde und zur Unterstützung beim Screening genutzt werden kann – den sogenannten DETECT-Algorithmus. Dieser berechnet einen Risikoscore aus verschiedenen Untersuchungsergebnissen.12
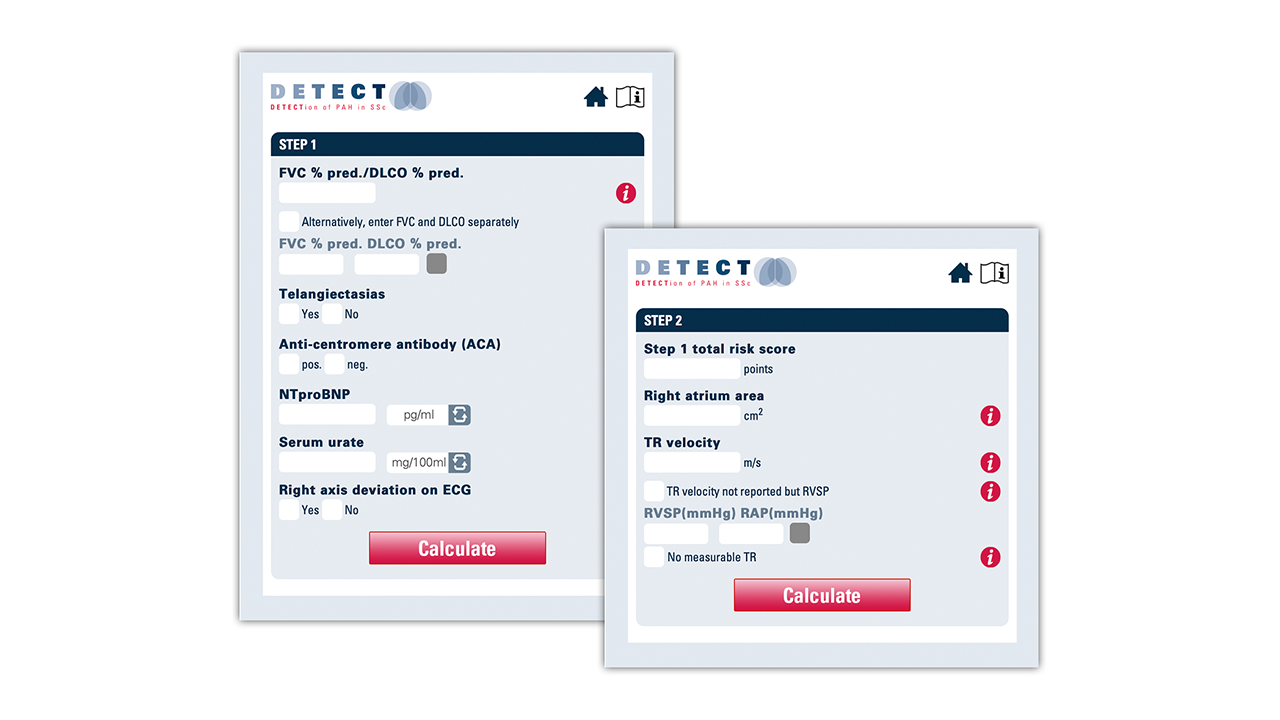
DETECT-Algorithmus: praktischer Risikokalkulator verfügbar
Um den DETECT-Algorithmus möglichst einfach anwenden zu können, wurde der PAH-Risikokalkulator entwickelt – ein praktisches Tool für die Routinepraxis.#, 13
Die Parameter werden einfach in den Kalkulator eingegeben und dieser errechnet gemäß des DETECT-Algorithmus eine Empfehlung, ob eine Überweisung zur Rechtsherzkatheteruntersuchung sinnvoll ist.13
# Der DETECT-Algorithmus ist ein Hilfsmittel zum Screening von SSc-Patient:innen auf Anzeichen einer PAH, eine PAH kann damit nicht diagnostiziert werden.
Warnungen und Vorsichtsmaßnahmen
Es wird empfohlen, den PAH-Risikokalkulator in Zentren zu verwenden, die auf die Behandlung von SSc-Patient:innen spezialisiert sind, und/oder in Zentren, die eng mit diesen spezialisierten SSc-Zentren zusammenarbeiten. Der PAH-Risikokalkulator darf nicht allein für die Diagnose einer PAH verwendet werden und ersetzt nicht die klinische Beurteilung durch PAH-Spezialist:innen. Der PAH-Risikokalkulator sollte von Fachleuten verwendet werden, die mit der Krankheit, ihrer Diagnose und Behandlung vertraut sind.
Eine langfristige Gültigkeit des Algorithmus kann nicht garantiert werden und es kann keine Empfehlung darüber abgegeben werden, wie häufig Patient:innen untersucht werden sollten. In die DETECT-Studie wurden nur Patient:innen mit einer Kohlenmonoxid-Diffusionskapazität (DLCO) von < 60 % aufgenommen.
Die Eingabe eines falschen Parameterwertes kann zu einem falschen Risikoscore führen. Um Missverständnisse über die zur Berechnung verwendeten Parameter zu vermeiden, gibt es für jeden Parameter in Schritt 1 und Schritt 2 ein Informationssymbol. Wenn Sie auf dieses Symbol klicken, werden die Informationen zu dem entsprechenden Parameter angezeigt.
Angeborene Herzfehler
Patient:innen mit angeborenen Herzfehlern haben ein erhöhtes Risiko für PAH
Die Entwicklung einer pulmonal arteriellen Hypertonie (PAH) ist bei Patient:innen mit angeborenen Herzfehlern eine bedeutsame Komplikation und stellt ein Kontinuum vom operablen Herzfehler bis zur schweren pulmonalvaskulären Erkrankung dar. Da eine chirurgische oder interventionelle Korrektur den klinischen Verlauf und die Prognose bei PAH aufgrund angeborener Herzfehler verbessern kann, ist eine frühe und korrekte Diagnosestellung wichtig.14
Wie häufig sind angeborene Herzfehler?
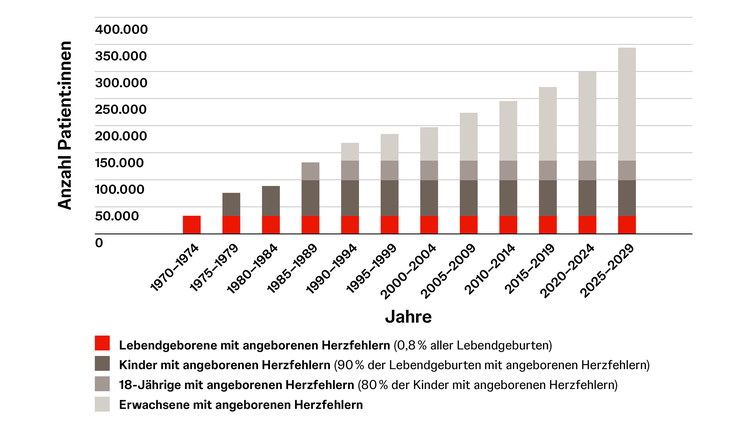
Angeborene Herzfehler gehören zu den häufigsten isolierten angeborenen Organfehlbildungen. In Deutschland sind jährlich etwa 6.500 Kinder davon betroffen. Verstarben früher noch 80 % der Kinder mit angeborenem Herzfehler innerhalb der ersten Lebensjahre, so erreichen heute dank Fortschritten in der Herzchirurgie sowie der pädiatrischen Kardiologie und Intensivmedizin mehr als 90 % das Erwachsenenalter. Dies zeigt sich auch in den Mortalitätszahlen, die in den letzten Jahrzehnten für Menschen mit angeborenen Herzfehlern deutlich zurückgegangen sind. Obwohl die Mortalität deutlich gesunken ist, besteht nach Korrektur oder Reparatur eines angeborenen Herzfehlers häufig das Risiko für Spätfolgen, wie die Entwicklung einer pulmonalen Hypertonie (PH) oder pulmonal arteriellen Hypertonie (PAH).14
PAH assoziiert mit angeborenen Herzfehlern
Laut Schätzungen entwickeln bis zu 10 % der Patient:innen mit angeborenen Herzfehlern eine P(A)H.14 Diese Form der PAH umfasst eine sehr heterogene Patientenpopulation und das klinische Bild kann sich deutlich von anderen P(A)H-Formen unterscheiden.1

Welche angeborenen Herzfehler spielen bei der Entwicklung einer PAH eine Rolle?
Grundsätzlich spielen für die mögliche Entwicklung einer pulmonalen Hypertonie (PH) oder einer pulmonal arteriellen Hypertonie (PAH) vor allem 4 Gruppen von angeborenen Herzfehlern eine Rolle. Diese können sowohl einfach als auch komplex bzw. selten oder häufig sein:
- Shuntvitien
- Angeborene Obstruktionen des linken Herzens
- Zyanotische Herzfehler mit vermehrtem Lungenfluss
- Anomalien der Pulmonalarterie
Eine weitere Gruppe umfasst Patient:innen mit univentrikulärem Herzen und Fontan-Zirkulation.14
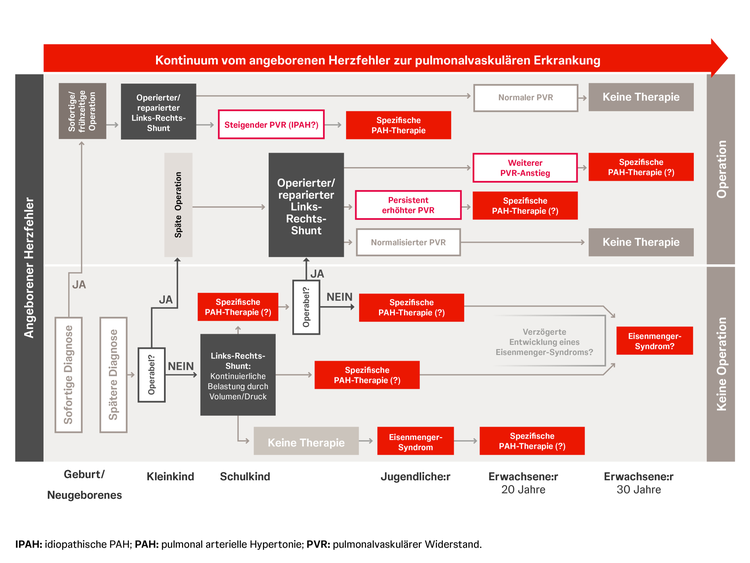
Klinische Klassifikation der PAH in Assoziation mit angeborenen Herzfehlern16, 17
Angeborene Herzfehler in Assoziation mit PAH werden weiterführend noch einmal verschiedenen Klassen zugeordnet. Diese umfassen das Eisenmenger-Syndrom, PAH bei Links-Rechts-Shunt, PAH, die zufällig mit einem angeborenen Herzfehler assoziiert ist, und PAH nach Defektkorrektur.16
Eisenmenger-Syndrom
- Herz-/Gefäßanomalien mit initialem systemisch-pulmonalen Shunt („Links-Rechts-Shunt”)
- Progredienter Anstieg des PVR über die Zeit und Entstehung eines bidirektionalen oder Rechts-Links-Shunts
- Klinisch gekennzeichnet durch Zyanose, sekundäre Erythrozytose und Multiorganbeteiligung
PAH bei Links-Rechts-Shunt (korrigierbar* oder nicht korrigierbar)
- Moderate bis große Defekte
- Gering- bis mittelgradiger systemisch-pulmonaler Blutfluss
- Keine Zyanose in Ruhe
PAH, zufällig mit einem angeborenen Herzfehler assoziiert
- Angeborener Herzfehler ist nicht Ursache der PAH
- Deutlich überhöhter PVR bei kleinen angeborenen Defekten, die primär nicht für erhöhten PVR verantwortlich sind#
- Klinisches Bild ähnelt idiopathischer PAH
- Defektverschluss ist kontraindiziert
PAH, nach Defekt-Korrektur
- Operativ/interventionell korrigierter angeborener Herzfehler
- PAH vorhanden (nach der Herzoperation persistierend oder nach Monaten/Jahren wieder auftretend), ohne hämodynamisch relevante Re-/Restshunts
Erstellt nach Apitz C et al. 202016 und Savale L et al. 201917
PAH: pulmonal arterielle Hypertonie; PVR: pulmonalvaskulärer Widerstand.
* Chirurgisch oder interventionell. # Der gemessene Diameter kennzeichnet nicht immer die hämodynamische Relevanz des Vitiums. Zur exakteren Beurteilung der Shunthämodynamik müssen Druckgradienten, Shuntgröße und -richtung sowie das Verhältnis von Lungenblut- und Systemblutfluss [Qp/Qs] Berücksichtigung finden.
Wie ist die Prognose für EMAH bei PAH?
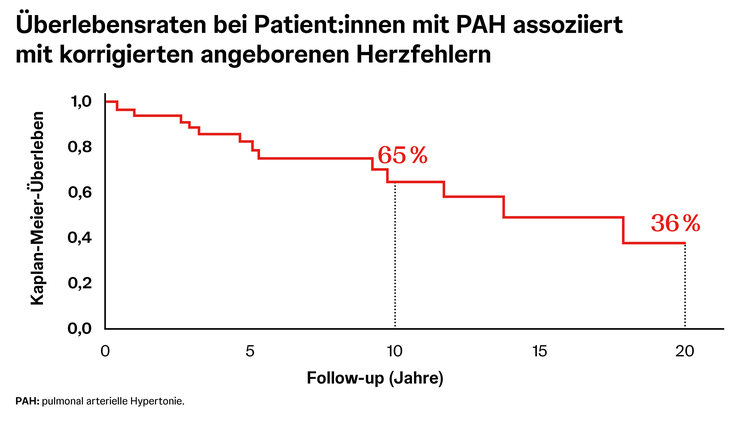
Insgesamt sind die Morbidität und die Mortalität der pulmonal arteriellen Hypertonie (PAH) bei Erwachsenen mit angeborenen Herzfehlern (EMAH) erheblich.18 Grundsätzlich ist das Überleben von EMAH mit PAH abhängig von der klinischen Subgruppe. Während die Überlebensraten für die ersten drei Subgruppen (Eisenmenger-Syndrom, PAH bei Links-Rechts-Shunt und PAH, die zufällig mit einem angeborenen Herzfehler assoziiert ist) nach 10 Jahren noch bei über 80 % liegen, verstirbt bei Patient:innen mit angeborenen korrigierten Herzfehlern 1 von 3 innerhalb von 10 Jahren nach PAH-Diagnose.18
Wie wird PAH in Assoziation mit angeborenen Herzfehlern diagnostiziert?
Da für die Diagnose einer pulmonal arteriellen Hypertonie (PAH) in Assoziation mit angeborenen Herzfehlern kein spezifischer Diagnosealgorithmus besteht, kann prinzipiell der P(A)H-Diagnosealgorithmus verwendet werden. Neben der korrekten Diagnose des zugrunde liegenden Herzfehlers sollte auch bei dieser Form der PAH eine funktionelle und hämodynamische Abstufung erfolgen. Eine frühe Diagnose ist sehr wichtig, da eine chirurgische oder interventionelle Korrektur des Herzfehlers den klinischen Verlauf und die Prognose bei PAH verbessern kann. Aufgrund der Komplexität des Krankheitsbildes sollte die Diagnose multidisziplinär abgeklärt werden und alle Patient:innen sollten an zertifizierte Spezialist:innen und EMAH-Zentren angebunden werden.15

Für Erwachsene mit angeborenen Herzfehlern (EMAH) wird ein regelmäßiges Screening empfohlen20, 21
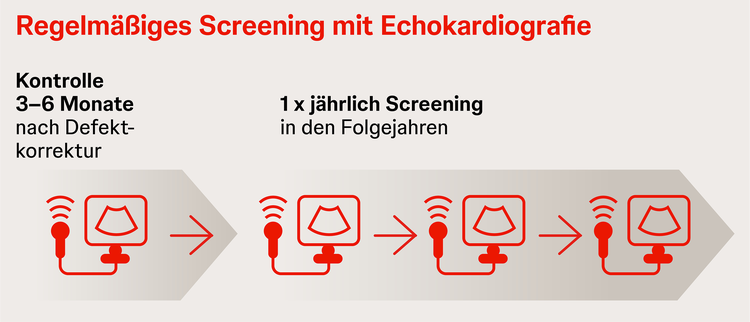
Daten aus dem COMPERA-Register zeigen, dass PAH bei mehr als 60 % der EMAH erst im fortgeschrittenen Stadium (WHO-Funktionsklasse III oder IV) diagnostiziert wird.19 Insbesondere bei Erwachsenen mit korrigierten angeborenen Herzfehlern wird daher ein regelmäßiges PAH-Screening mit Echokardiografie empfohlen.20, 21
Wodurch kann die Diagnose von PAH in Assoziation mit angeborenen Herzfehlern verzögert werden?
Obgleich die Mortalität bei angeborenen Herzfehlern deutlich gesunken ist, wird die Morbidität im weiteren Verlauf häufig unterschätzt. Die pulmonal arterielle Hypertonie (PAH) ist neben Herzinsuffizienz, Endokarditis und Herzrhythmusstörungen ein wichtiger Folgezustand bei angeborenen Herzfehlern. Obwohl mit diesen Folgezuständen gerechnet werden muss, werden viele Patient:innen bislang nicht entsprechend von Spezialist:innen oder erfahrenen Zentren betreut. Daher ist es wichtig, bereits im niedergelassenen Bereich an mögliche Folgezustände wie PAH bei Patient:innen mit angeborenen Herzfehlern zu denken und frühzeitig eine adäquate Diagnostik einzuleiten.14
EMAH: So können bei EMAH mögliche Barrieren für eine frühzeitige PAH-Diagnose überwunden werden
Reibungslose Transition ermöglichen
Um eine optimale Transition zur Behandlung als Erwachsener mit angeborenem Herzfehler zu ermöglichen, sollten die Patient:innen in ihrer Kindheit und Jugend bis ins Erwachsenenalter regelmäßige Nachsorgeuntersuchungen und Transitions-Unterstützung erhalten.22, 23
Compliance verbessern
Unabhängig vom Alter oder Erfolg der Defektkorrektur müssen Patient:innen mit angeborenem Herzfehler, die für die Nachsorge „verloren gegangen sind“, identifiziert und wieder zu Spezialist:innen zur regelmäßigen Langzeitkontrolle überwiesen werden.22, 24
Bei unspezifischen Symptomen an PAH denken
Um eine PAH frühzeitig zu diagnostizieren, sollten die Patient:innen ein Routine-Screening auf PAH mittels Echokardiografie zur Bestimmung der maximalen TRG und anderer Anzeichen für PAH erhalten.1
Viele EMAH sind nicht an zertifizierte Spezialist:innen und EMAH-Zentren angebunden
Eine fragebogenbasierte Querschnittsstudie hat gezeigt, dass die Versorgungssituation für Erwachsene mit angeborenen Herzfehlern (EMAH) in Deutschland stark verbesserungsbedürftig ist. Ende 2020 umfasste das Versorgungsnetz in Deutschland 20 „überregionale EMAH- Zentren“, 10 „EMAH-Schwerpunktkliniken oder -praxen“ sowie über 300 zertifizierte Kardiolog:innen oder Kinderkardiolog:innen.25 Obwohl der Bedarf nach spezialisierter Betreuung bei EMAH hoch ist, werden der Umfrage nach mehr als die Hälfte allgemeinmedizinisch und kardiologisch nur von ihren Hausärzt:innen betreut und sind nicht an ein spezialisiertes EMAH-Zentrum angebunden.25 Weniger als ein Drittel der Hausärzt:innen fühlen sich ausreichend über die EMAH-Versorgungsstrukturen informiert.25

Bundesweite EMAH-Versorgungsstruktur vorhanden
Nach Daten des Deutschen Herzberichts und der fragebogenbasierten Querschnittsstudie ist nur ein Bruchteil der EMAH in Deutschland an eines der flächendeckend vorhandenen spezialisierten Zentren angebunden. Da die Beratung und das kardiologische Management von EMAH allerdings sehr komplex ist und es in Kombination etwa 150 verschiedene angeborene Herzfehler gibt, ist es wichtig, dass EMAH nicht nur hausärztlich, sondern auch in den spezialisierten Zentren betreut werden. Das Netz zur EMAH-Versorgung in Deutschland umfasst daher gegenwärtig sowohl überregionale EMAH-Zentren als auch EMAH-Schwerpunktkliniken und EMAH-Schwerpunktpraxen.25
Deutsche Kinderherzstiftung
Auf der Website der Kinderherzstiftung finden Sie eine Liste der Pädiater:innen und Internist:innen mit EMAH-Zusatzqualifikationen.
Herzkind e. V.
Die Website des Vereins Herzkind e. V. listet Kinderherzzentren nach Postleitzahlen auf.
Deutsche Gesellschaft für Kardiologie (DGK)
Bei der DGK können Sie die am nächsten liegenden zertifizierten EMAH-Zentren in Ihrem Umkreis finden.
Kompetenznetz angeborene Herzfehler
Das Kompetenznetz für angeborene Herzfehler bietet eine Auflistung von Herzkliniken und -zentren, die auf angeborene Herzfehler spezialisiert sind.
HIV-Infektion
Patient:innen mit HIV-Infektion haben ein erhöhtes Risiko für PAH
Der breite Einsatz von kombinierten antiretroviralen Therapien hat das Überleben bei Patient:innen mit Infektionen des humanen Immundefizienz-Virus (HIV) deutlich verbessert. Das hat allerdings auch zu einem erhöhten Auftreten von Folgekrankheiten wie pulmonal arterieller Hypertonie (PAH) in dieser Patientengruppe geführt. Bisher ist nicht eindeutig geklärt, ob die HIV-Infektion der Auslöser oder ein beitragender Faktor für die Entwicklung einer PAH ist. Gleiches gilt für den genauen Mechanismus bei der Entwicklung einer mit HIV-Infektion assoziierten PAH.26
Was passiert bei einer HIV-Infektion?
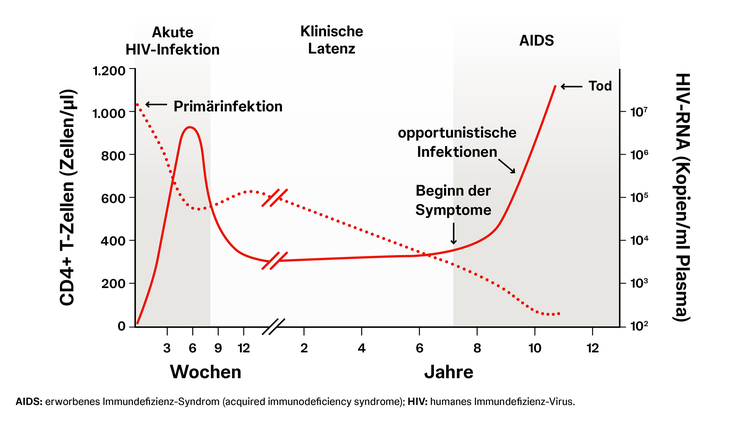
Weltweit sind etwa 34 Millionen Menschen mit dem humanen Immundefizienz-Virus (HIV), einem Lentivirus aus der Familie der Retroviren, infiziert. Das Virus enthält zwei Einzelstränge RNA, die in der Wirtszelle durch die viral kodierte Reverse Transkriptase in Doppelstrang-DNA konvertiert und in das Wirtsgenom eingesetzt werden. Dort verbleibt das Virus entweder latent oder wird alternativ von der Zelle transkribiert und vermehrt sich auf diese Art weiter. Bei einer HIV-Infektion unterscheidet man 3 Stadien: akute Infektion, klinische Latenz und erworbenes Immundefizienz-Syndrom (acquired immunodeficiency syndrome (AIDS)), das finale Stadium einer HIV-Infektion. AIDS wird entweder durch weniger als 200 CD4+ T-Zellen pro µl oder das Auftreten von spezifischen HIV-assoziierten Infektionen (Infektionen mit Zytomegalievirus, Varizella-Zoster-Virus, BK-Virus, Herpes-simplex-Virus, Pneumocystis jirovecii, Toxoplasma gondii oder Pilzen) definiert. Ohne spezifische Therapie entwickelt die Hälfte der HIV-infizierten Patient:innen innerhalb von 10 Jahren AIDS.27
Wie häufig tritt PAH in Zusammenhang mit HIV-Infektionen auf?
Obwohl eine Infektion mit dem humanen Immundefizienz-Virus (HIV) mit kombinierten antiretroviralen Therapien unterdrückt werden kann, ist eine Heilung bisher nicht möglich. Trotzdem ist eine HIV-Infektion heutzutage eher eine chronische als eine akut lebensbedrohliche Erkrankung geworden. Daher rücken Langzeitfolgen wie vaskuläre Komplikationen immer mehr in den Fokus. Eine mögliche dieser Komplikationen ist die pulmonal arterielle Hypertonie (PAH).27 In einer Meta-Analyse, die ein Screening auf PH durch Echokardiografie zugrunde legte, wurde die globale PH-Prävalenz bei Erwachsenen mit HIV-Infektion auf 8,3 % geschätzt.26

Lebererkrankungen
Patient:innen mit Lebererkrankungen haben ein erhöhtes PAH-Risiko
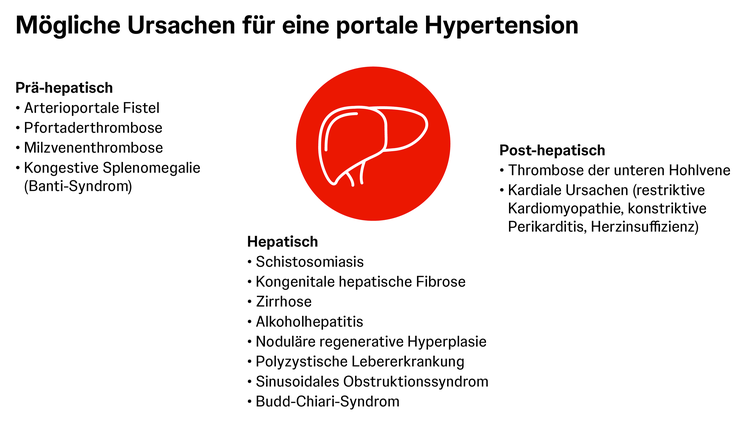
Die portale Hypertension, auch portale Hypertonie oder Pfortaderhochdruck genannt, ist eine bekannte Ursache für die sogenannte portopulmonale Hypertonie (PoPH) – eine Form der assoziierten pulmonal arteriellen Hypertonie (PAH).1, 29 Oft zeigen Patient:innen sowohl Anzeichen für eine portale Hypertension als auch für PAH, die typischen Symptome der portalen Hypertension gehen denen der PAH, wie z. B. Dyspnoe, allerdings in der Regel voraus.30 Einer portalen Hypertension können verschiedene Lebererkrankungen zugrunde liegen, am häufigsten kommt eine PoPH jedoch bei Patient:innen mit Leberzirrhose vor.30, 31

Was ist eine portale Hypertension?
Die portale Hypertension ist ein klinisches Syndrom, das durch eine Erhöhung des Pfortaderdrucks (auch portalvenöser Druck) gekennzeichnet ist (> 5 mmHg). Klinisch signifikant wird eine portale Hypertension bei einer Druckerhöhung über 10–12 mmHg, da ab diesem Bereich Komplikationen, wie z. B. portopulmonale Hypertonie (PoPH), auftreten.30
Wie entsteht eine portale Hypertension?
Eine portale Hypertension entsteht, wenn der intrahepatische Widerstand in den Lebergefäßen steigt (z. B. durch Leberzirrhose) und ein erhöhter Blutfluss aufgrund erhöhter Vasodilatation im Splanchnikus-System (Bauchorgane) auftritt. Dies kann verschiedene prä-hepatische, intrahepatische und post-hepatische Ursachen haben, in bis zu 90 % der Fälle ist jedoch eine Leberzirrhose der Auslöser für eine portale Hypertension.30
Was sind die Folgen einer portalen Hypertension?
Die Komplikationen einer portalen Hypertension umfassen unter anderem Varizenblutungen, spontane bakterielle Peritonitis und das hepatorenale Syndrom – die Hauptursachen für Mortalität oder Lebertransplantationen bei Patient:innen mit Leberzirrhose.30
Eine schwerwiegende pulmonalvaskuläre Komplikation stellt die portopulmonale Hypertonie dar.29
Wie häufig tritt eine PoPH auf?
Die genauen Pathomechanismen, die bei der Entwicklung einer portopulmonalen Hypertonie (PoPH) eine Rolle spielen, sind bisher ungeklärt. Frauen und Patient:innen mit Autoimmunerkrankungen scheinen allerdings häufiger betroffen zu sein.32
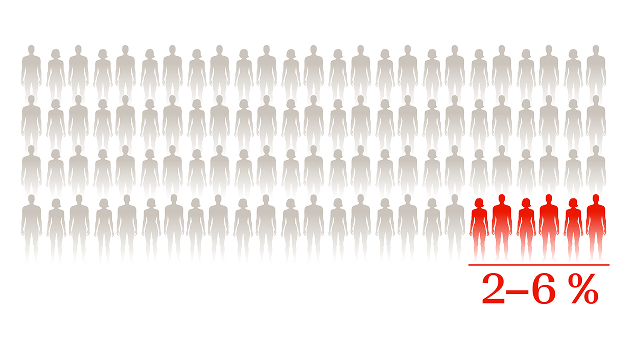
Etwa 2–6 % der Patient:innen mit portaler Hypertension entwickeln eine PoPH.1 Da die Leberzirrhose der häufigste Grund für eine portale Hypertension ist, tritt die PoPH auch am häufigsten bei Patient:innen mit Leberzirrhosen auf.30 Innerhalb der Gruppe der pulmonal arteriellen Hypertonie (PAH) liegt der Anteil der Patient:innen mit PoPH bei 6–18 %. Da die PoPH häufig unterdiagnostiziert ist, könnte die Dunkelziffer jedoch auch höher liegen.31
Das könnte Sie auch interessieren:

Hier finden Sie interessante aktuelle Fachbeiträge zu unterschiedlichen Themen.

Prof. Ralf Ewert, PD Dr. Hans Klose und Prof. Dr. Dirk Skowasch tauschen sich zum Thema pulmonal arterielle Hypertonie aus.

Erfahren Sie mehr über das Produktportfolio von Johnson&Johnson in der pulmonal arteriellen Hypertonie.
Quellen
- Humbert M et al. Eur Heart J 2022; 43(38): 3618–3731.
- Badesch DB et al. Chest 2010; 137(2): 376–387.
- Chung L, Kawut SM. Eur Respir J 2014; 44(4): 839–841.
- Herold G et al. in: „Innere Medizin“, Kapitel „Kollagenosen“, Herold-Verlag (Hrsg.) 2017; 671–681.
- Morrisroe K et al. Arthritis Res Ther 2017; 19(1): 42.
- Matucci-Cerinic M et al. Ann Rheum Dis 2009; 68(9): 1377–1380.
- Distler O, Gay S. Internist 2010; 51: 30–38.
- Aithala R et al. Int J Rheum Dis 2017; 20(1): 5–24.
- Kolstad KD et al. Chest 2018; 154(4): 862–871.
- Chung L et al. Chest 2014; 146(6): 1494–1504.
- Humbert M et al. Arthritis Rheum 2011; 63(11): 3522–3530.
- Coghlan JG et al. Ann Rheum Dis 2014; 73(7): 1340–1349.
- DETECTion of PAH in SSc. Erhältlich unter: https://www.detect-pah.com/ (link is external) (letzter Zugriff: 10.04.2025).
- Neidenbach R et al. Z Herz- Thorax- Gefäßchir 2017; 31(4): 228–240.
- Kaemmerer H et al. Int J Cardiol 2018; 272S: 79–88.
- Apitz C et al. S2k-Leitlinie Pulmonale Hypertonie, Geltungsbereich: Pulmonale Hypertonie des gesamten Kindes- und Jugendalters bis ins junge Erwachsenenalter; Stand: 29.04.2020.
- Savale L, Manes A. Eur Heart J Suppl 2019; 21(Suppl K): K37–K45.
- Manes A et al. Eur Heart J 2014; 35(11): 716–724.
- Kaemmerer H et al. J Clin Med 2020; 9(5): 1456.
- Frost A et al. Eur Respir J 2019; 53(1): 1801904.
- Dimopoulos K et al. J Am Coll Cardiol 2018; 72(22): 2778–2788.
- Mackie AS et al. Circulation 2009; 120(4): 302–309.
- Baumgartner H et al. Eur Heart J 2020; 42(6): 563–645.
- Kaemmerer H et al. Dtsch Med Wochenschr 2021; 146(18): 1192–1199.
- Kaemmerer H et al. Internist 2022; 63: 95–102.
- Bigna JJ et al. Sci Rep 2019; 9(1): 7837.
- Correale M et al. Eur J Clin Invest 2015; 45(5): 515–528.
- Spektrum.de: Lexikon der Biologie, HIV-Infektion. Erhältlich unter: https://www.spektrum.de/lexikon/biologie/hiv-infektion/32100 (letzter Zugriff: 10.04.2025).
- Medarov BI et al. Respir Med 2014; 108(7): 943–954.
- Al-Busafi SA et al. Int J Hepatol 2012; 2012: 203794.
- Savale L, Manes A. Eur Heart J Suppl 2019; 21(Suppl. K): K37–K45.
- Aldenkortt F et al. World J Gastroenterol 2014; 20(25): 8072–8081.
Zuletzt geändert am: 11.06.2025
Unser Angebot erfüllt die afgis-Transparenzkriterien.
Die afgis-Zertifizierung steht für hochwertige Gesundheitsinformationen im Internet. Die Prüfung durch insgesamt zehn umfangreiche Kriterien bestätigt, dass die J&J Medical Cloud den medizinischen Fachkreis über gesundheitsrelevante Themen in seriöser, aktueller und qualitätsgesicherter Weise informiert.
EM-148885
